使用 ReacSight 增强生物反应器阵列以实现自动测量和反应控制(下)
如需获取原文献 请关注公众号

编者按
本 期 推文 ,我们 编 译 了 François Bertaux 等 发 表 在 Nature Communications 期刊上的研究论文《使用 ReacSight 增强生物反应器阵列以实现 自动测量和反应控制》(Enhancing bioreactor arrays for automated measurements and reactive control with ReacSight),该文介绍了 ReacSight,一种用于自动测量和 反应实验控制的增强生物反应器阵列的策略。因文章篇幅较长,共分为三期叙述,本期是最后一期,如需查看前文,请点击文末链接自动跳转。感谢关注!
目录
/CONTENT
01/引言
02/结果
2.1 测量自动化、平台软件集成和 ReacSight 的反应性实验控制
2.2 反应性光遗传控制和酵母连续培养的单细胞解析特性
2.3 使用光实时控制基因表达
2.4 探索营养缺乏对健康和细胞压力的影响
2.5 ReacSight 是一种通用策略:通过吸液功能增强平板阅读器
03/讨论
接上文
2.4
探索营养缺乏对健康和细胞压力的影响
荧光蛋白可以作为报告物来评估细胞的表型特征,也可以作为条形码来标记具有特定基因型的菌株。再加上生物反应器阵列的自动细胞仪,这种能力扩展了可能的实验范围:在动态控制环境中的多重菌株特性和竞争(图 4a)。事实上,一些荧光蛋白可用于基因分型,其他可用于表型分型。然后,自动细胞仪(包括原始数据分析)将提供关于不同菌株之间竞争动态和每个菌株的细胞状态分布动态的定量信息。根据实验的目标,这些丰富的信息可以反馈给实验控制,以适应每个反应器的环境参数。
作为可以进行此类实验的概念的第一个证明,作者开始探索营养缺乏对健康和细胞压力的影响(图 4b,左上角)。微生物群落中的不同物种根据其代谢多样性或专业性有不同的营养需求,因此它们的适合性不仅取决于外部环境因素,还取决于群落本身通过营养物质消耗、代谢物释放和其他细胞间耦合。与分批竞争分析相反,连续培养允许控制这些因素。例如,在恒浊器培养基中,营养素的可用性取决于营养素供应(即输入介质中的营养素水平)和细胞的营养素消耗(主要取决于 OD 设定值)。作者使用组氨酸营养不良作为营养缺乏的模型:对于 his3 突变细胞,组氨酸是一种必需的营养素。通过将 his3 突变细胞与野生型细胞在不同 OD 设定值和喂养介质中不同组氨酸浓度下进行竞争,可以测量营养缺乏如何影响适应性(图 4b,右上角)。在这两个菌株中使用应激报告子也可以了解营养缺乏情况下适应性和细胞压力之间的关系。作者将重点放在未折叠蛋白反应 (UPR)应激上,以研究营养应激是否会导致其他事先无关的应激类型,这将表明细胞生理学中的全局耦合。
组氨酸浓度为 4µM 时,在考虑的 OD 设定值(0.1-0.8)范围内,his3 突变细胞被野生型细胞强烈竞争(图 4b,左下角)。当浓度为 20µM 时,情况不再如此。在这种浓度下,野生型细胞的生长速度优势在 OD 设定值 0.6 以下接近零(剩余组氨酸足以使 his3 突变细胞正常生长),在最大 OD 设定点 0.8 时超过 0.2 h −1(剩余组胺过低,限制了 his3 突变体细胞的生长)。因此,对于这种营养供应水平,细胞的营养消耗水平对 his3 突变细胞的适应性有很大影响。4µM 到 20µM 之间 的这种定性变化与组氨酸的单个高亲和力转运体 HIP1 的 Km 常数报告值 17µM 高度一致。此外,因为组氨酸浓度为 4µM 的野生型和突变型细胞之间的生长速度差异接近甚至超过野生型细胞通常观察到的生长速度(在 0.3 到 0.45 h −1之间, 取决于 OD 设定值),作者得出结论,突变细胞在这些条件下完全生长。UPR 数据显示,在组氨酸浓度为 20µM 的所有 OD 设定点上,突变细胞和野生型细胞之间几乎没有差异,但在组氨酸含量为 4µM 时,突变细胞中的 UPR 反应明显激活 (图 4b,右下角)。因此,看似相似的生长表型(例如 4 和 20µM OD 为 0.8 的突 变细胞)可能对应于不同的生理状态(如不饱和蛋白反应应激水平的差异所揭示的)。
此外,为了展示基于菌株丰度数据的环境反应控制,作者着手动态控制两个菌株的比率。控制微生物培养物的组成和异质性有望实现更有效的生物加工策略。作者推断,当两种菌株中的一种对组氨酸具有营养缺陷时,培养物的 OD 可以用作方向盘。事实上,组氨酸生物合成突变生长速率在 20µM 的中等组氨酸浓度下对 OD 的强烈依赖性(图 4b,左下角)意味着可以通过切换恒浊器培养物的 OD 设定值来动态控制其生长速率。此外,如果这种菌株与组氨酸原营养菌菌株共同培养,但以 OD 独立的方式生长较慢,则可以实现两种菌株比率的双向控制(图 4c,左)。作者利用繁重的异源蛋白分泌构建了这种菌株。然后,作者构建了一个简单的模型来预测组氨酸营养不良菌株的(稳态)生长速率差异。将此模型用于模型预测控制和 ReacSight 事件系统,作者可以以完全自动化的方式在平行生物反应器(图 4c,右)中保持两种菌株的不同比率。然而,作者注意到稳态误差的系统存在。这种行为可能是由于慢菌株的生长速度意外恢复所致。由于在特征化实验中未观察到这种行为,作者假设这种差异是由于特征化或对照实验中使用的氨基酸供应混合物的组成不同(除了组氨酸外,Sigma 的组氨酸缺失补充物比 Formedium 的完整补充物更丰富)。

图 4 探索和利用适应性、营养缺乏和细胞应激之间的关系。a 由于共培养、自动细胞仪和反应性实验控制,结合单细胞基因分型和表型分型的实验得以实现,以实时适应环境条件。b 左上角:必需营养素的可用性(例如 his3 突变株的组氨酸)取决于环境供应,也取决于通过营养素消耗的细胞密度。营养素供应不足会阻碍生长速度,并可能引发细胞应激。右上角:实验设计。野生型细胞(标记为 mCerulean 组成表达)与 his3 突变细胞共同培养。这两个菌株都含有一个 UPR 应激报告基因 mScarlet-I 的驱动表达。自动细胞仪能够将单个细胞分配 给其基因型,并监测菌株特异性 UPR 激活。这两种菌株相对数量的动态可以 推断突变细胞和野生型细胞在每种情况下的生长速度差异。左下图:两种不同介质组氨酸浓 度下突变细胞适应度缺陷的细胞密度依赖性。虚线表示野生型增长率对 OD 设定值的近似依赖性。右下角:每种情况下的菌株特异性 UPR 激活。c 左:双应变联合体的原理,其组成可以通过 OD 控制来控制。右:实施和演示。异源难折叠蛋白的分泌被用作营养独立的慢生长表型。使用模型预测控制和 ReacSight 事件系统对 OD 设定值进行动态控制,类似于图 3b (参见方法)。在时间 0 时开始蓝光,并在整个实验期间保持亮起,以诱导慢 his+菌株的慢 生长表型。作者注意到系统存在稳态误差,测得的比率低于目标值。在补充注释 3 中,作者 研究了限制控制性能的机制(慢生长表型的不稳定性、菌株识别错误和模型中未考虑的延 迟),还提供了其他控制实验的结果。源数据作为源数据文件提供。
2.5
ReacSight 是一种通用策略:通过吸液功能增强平板阅读器
为了说明 ReacSight 的通用性,将其作为通过连接实验室设备来生长细胞和 /或测量细胞读数以及吸管机器人来创建实验平台的策略,作者将 Tecan 平板阅读器与 Opentrons 吸管机器人连接起来(图 5a)。移液机器人和驱动读板器的计算机通过 Flask 连接。因为无法访问平板阅读器的 API,所以再次使用了基于 pyautogui 的“点击”控制策略。
在第一个应用中,作者使用移液机器人在生长条件下长时间保持细菌细胞数量。更具体地说,大肠杆菌临床分离物在两种不同的培养基(M9 葡萄糖加或不加 casamino 酸)中生长,并存在不同浓度的头孢噻肟(CTX),一种β-内酰胺抗生素。由于β-内酰胺酶的表达,所选菌株对头孢噻肟处理具有耐药性。它对 CTX 的最低抑制浓度为 2 mg/L。当细胞群 OD 的中位数达到目标水平时,介质将按照补偿蒸发的策略更新(图 5b,左)。通过所选策略,作者能够在至少 15 代细胞中 保持 OD 中值接近所选目标(0.05 或 0.1)(图 5b 右图)。有趣的是,作者观察到,当用 1 mg/L 头孢噻肟处理时,细胞在葡萄糖+酪氨酸钠中的抵抗力比单独在葡萄糖中更好。这有些令人惊讶,因为β-内酰胺类抗生素通常对快速生长的细胞有更强的影响。
在第二个应用中,作者使用该平台测试了在不同细胞密度下应用第二剂量头孢噻肟的效果。这些实验在概念上非常简单,但其结果很难预测。低浓度头孢噻肟抑制参与细胞分裂的 PBP3 蛋白,从而导致细丝形成,而高浓度头孢噻肟则抑制参与细胞壁维持的 PBP1 蛋白,并导致细菌溶解。由于成丝作用,即使没有细胞分裂,种群生物量在延长的时间内也可能继续呈指数增长。此外,死亡细胞释 放的β-内酰胺酶在环境中降解抗生素。这导致了细胞死亡和抗生素降解之间的时间赛跑,丝状物有助于延迟这一赛跑,同时增加生物量(图 5c 左)。因此,在不同细胞密度下应用第二剂量抗生素的实验有可能启发人们理解不同的作用(图 5c 中间)。当以 5 10−4 的光学密度开始时,单次处理的结果与分离物的 MIC 一 致,因为高于 MIC 的处理会导致生长明显停滞,而低于 MIC 的处理不会(图 5c, “培养基处理”)。还可以观察到,在前一种情况下,生长在数小时后恢复,这是酶介导的抗生素耐受的典型行为。这两个观察结果在使用 16 mg/L CTX 进行第二次处理的情况下仍然有效。有趣的是,当处理后生长停止时,OD 大约是处理时 OD 的 25 倍:12 10−3 ,6 10−2 和 12 10−2,处理时分别为 5 10−4 , 2.5 10−3 和 5 10−3。这表明,生长停止前活细胞对抗生素的降解是有限的,因此,生长停止之前只有有限数量的细胞死亡。因此,对抗生素处理的耐受性使细胞在死亡前的生物量增加了近 25 倍,然后由于酶介导的抗生素降解,使细胞在处理中存活下来,远远 超过其 MIC。还可以观察到,当初始处理为 4 mg/L 时,生长停止和再生之间的延迟相对恒定(~5 小时),与添加的抗生素总量无关(4 或 20 mg/L CTX)。这表明,生长停止后抗生素降解非常有效,延迟主要对应于无法检测到的再生所需的时间,此时活细胞的动态被死亡生物的光密度所掩盖。在作者的条件下,当第一次处理有效(4 或 16 mg/L)时,第二次处理似乎几乎没有效果。需要进行深入研究,以更量化的方式调查这些影响。
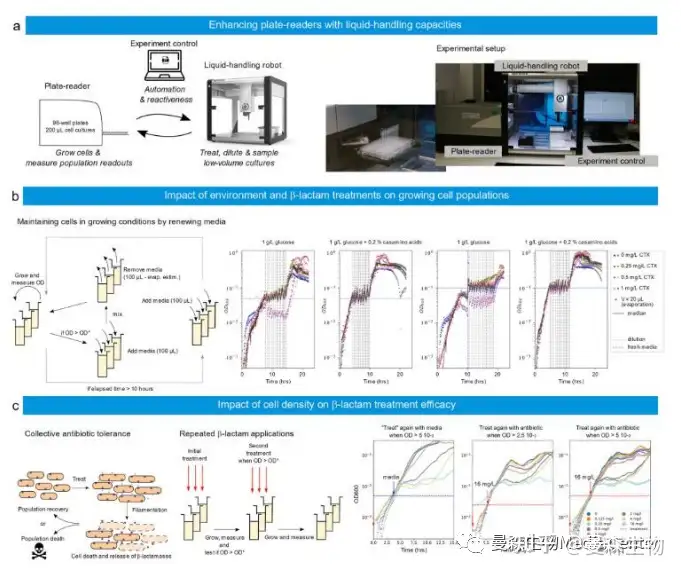
图 5 基于 ReacSight 的自动化平台组装,实现反应控制和低容量细菌培养物的表征。a 平台 概述。Opentrons OT-2 移液机器人用于提高读板器(Spark、Tecan)的容量。机器人用于在预先定义的 OD 处处理平板读取器中的培养物。b 左:大肠杆菌临床分离物可以通过以 OD 控制的方式更新培养基来维持在生长条件下。必须注意补偿延长时间范围内的蒸发。右图:富培养基中的细胞(葡萄糖+casaminoacids vs 单独葡萄糖)生长更快,但抵抗更好的亚 MIC 抗生素处理。左:由于两种效应的结合,细菌种群可能表现出对处理的恢复力。在单细胞水 平上,细胞可能通过丝状化耐受超过其 MIC 的抗生素浓度。基于纤维的耐受性允许在细胞 死亡之前增加生物量。在种群水平上,抗生素被环境中细胞死亡时释放的酶降解。最终结果 取决于细胞死亡和抗生素降解之间的竞争。中间:这两种效应的各自作用可以通过反复抗生 素处理来研究。右图:大肠杆菌临床分离物在初始 OD 为 5 10−4 时用不同浓度的 CTX(图 例)处理,第二次使用 16 mg/L CTX(红色)或单独使用介质(蓝色),使用用户定义的 OD (2.5 10−3 或 5 10−3 ). 由于仪器限制,OD 读数低于 10−3 个可靠性较差。源数据作为源数据文 件提供。
03
讨论
作者报道了 ReacSight 的开发,这是一种通过自动测量和反应实验控制来增 强多生物反应器设置的策略。ReacSight 通过允许研究人员将低成本开放硬件仪器(如 eVOLVER、Chi.Bio)和多功能、模块化、可编程移液机器人(如 Opentrons OT-2)与敏感但通常昂贵的独立仪器相结合,构建全自动化平台,大大拓宽了可行实验的范围。作者还证明,ReacSight 可用于增强具有吸液能力的平板阅读器。ReacSight 是通用的,易于部署,应该广泛用于微生物系统生物学和合成生物学社区。正如 Wong 及其同事所指出的,将多生物反应器装置连接到细胞仪进行自动测量,可以实现微生物培养物的单细胞分辨特性。事实上,在微生物系统和合成生物学的背景下,自动化细胞术几年前已经被少数实验室证明,但低吞吐量或依赖昂贵的自动化设备可能会阻碍这项技术的广泛采用。来自连续培养物的自动细胞仪与最近开发的光遗传学系统相结合,变得特别强大,能够对细胞过程进行有针对性、快速和成本效益的控制。作者使用 ReacSight 将两种不同的生物反应器设置(预先存在的自定义设置和最近的 Chi.Bio-optogenetic-ready 生物反应器) 与细胞仪连接起来。这证明了 ReacSight 战略的模块化,而使用 Chi Bio 生物反应器的平台版本说明了其他缺乏现有生物反应器设置的实验室如何能够以较小的时间和财务成本(不包括细胞仪的成本,尽管其价格昂贵,但即使在缺乏自动化的情况下也已经在实验室中广泛使用)构建这样的平台。作者通过以全自动方式并在不同的反应器中并行执行(1)光驱动的基因表达实时控制,展示了该平台的关键能力;(2)在严格控制的环境条件下,基于细胞状态的竞争分析;动态 控制两个菌株之间的比值。
然而,作者只触及了这些平台提供的巨大潜在应用空间的表面。最近通过核 糖体移码技术证明,菌株条形码可以扩展到 20 株带有两个荧光团的菌株,甚至可以扩展到 100 株带有三个荧光团。这种多路复用能力对于并行描述各种候选路径的输入-输出响应(或菌株背景库中路径行为的依赖性)特别有用(在反应器中 使用不同的光感应)。免疫珠可用于更多样化的基于细胞术的测量(机器人可实 现自动孵化和清洗,例如使用 Opentrons OT-2 磁性模块)。表面显示或 GPCR 信号等技术也可用于设计生物传感器菌株,用单细胞仪测量更多培养物尺寸,无需试剂成本。除了高性能的定量菌株表征外,此类平台还可用于生物技术应用。基于自动细胞仪的人工微生物联合体的组成,以及培养条件的动态控制(如本文所示,使用组氨酸营养不良和 OD),可以大大减少设计稳健共存机制的需要,因此可以使用更大多样性的联合体。
未来,希望许多基于 ReacSight 的平台将被组装起来,它们的设计将被广泛的社区共享,以大幅扩展实验能力,从而解决微生物学的基本问题,并释放合成生物学在生物技术应用中的潜力。
全文完
参考文献:Bertaux, F., Sosa-Carrillo, S., Gross, V. et al. Enhancing bioreactor arrays for automated measurements and reactive control with ReacSight. Nat Commun 13, 3363 (2022). https://doi.org/10.1038/s41467-022-31033-9
由于篇幅受限,关于上述文章原文献详见公众号右下角底部菜单栏→补充资料,自动跳转获取
Mediacenter Editor | 曼森编辑
文章来源:本文由中科院上海生命科学信息中心与曼森生物合作供稿
排版校对:刘娟娟编辑
内容审核:郝玉有博士







