使用 ReacSight 增强生物反应器阵列以实现自动测量和反应控制(中)
如需获取原文献/补充资料 请关注公众号

目录
/CONTENT
01/引言
02/结果
2.1 测量自动化、平台软件集成和 ReacSight 的反应性实验控制
2.2 反应性光遗传控制和酵母连续培养的单细胞解析特性
2.3 使用光实时控制基因表达
2.4 探索营养缺乏对健康和细胞压力的影响
2.5 ReacSight 是一种通用策略:通过吸液功能增强平板阅读器
03/讨论
2.2 反应性光遗传控制和酵母连续培养的单细胞解析特性
作者首次应用 ReacSight 策略的动机是酵母合成生物学应用。在这种情况下,精确控制合成路径并在定义明确的环境条件下测量其输出,并具有足够的时间分辨率和范围是至关重要的。光遗传学为控制合成路径提供了一种极好的方法,生物反应器支持的连续培养是对环境条件进行长时间严格控制的理想方法。为了测量单个细胞的路径输出,细胞术提供了高灵敏度和高通量。因此,借助 ReacSight 策略,利用台式细胞仪作为测量设备,组装了一个完全自动化的实验平台,实现了对酵母连续培养物的反应性光遗传学控制和单细胞解析表征(图 2a)。
补充说明 2 提供了平台硬件和软件的详细信息,此处仅讨论关键要素。八个反应器与移液机器人相连,这意味着每个时间点都会填满一列取样板。虽然机器人可以接触到三列细胞仪输入板,但作者仅使用一列,由机器人进行广泛清洗,以实现小于 0.2%的残留,使用免疫磁珠进行验证。通常在机器人平台上安装两个倾翻箱和两个取样板(2×96=192 个样本),因此,在没有任何人为干预的情况下,八个反应器中的每一个都有 24 个时间点。为了实现基于细胞数据的反应性实验控制,作者开发并实施了算法,以在重叠荧光团之间执行自动选通和光谱反褶积(图 2b)。
作者首先通过对组成性表达来自染色体整合转录单位的各种荧光蛋白的酵母菌株进行长期恒浊培养来验证平台的性能(图 2c)。荧光团水平的分布是单峰的,随着时间的推移是稳定的,正如在具有组成型启动子的稳定生长条件下所预期的那样。mNeonGreen 和 mScarlet-I 在单色和三色菌株之间的分布完全重叠。这与从强 pTDH3 启动子表达一个或三个荧光蛋白对细胞生理学的影响可以忽略不计的假设是一致的,并且三色菌株中转录单位的相对位置(mCerulean 第一, mNeonGreen 第二,mCarlet-I)对基因表达的影响很小。与单色品系相比,三色品系中测得的 mCerulean 水平略高(~15%)。这可能是由于反褶积中的残余误差造成的,与自荧光和 mNeonGreen 相比,mCerulean 的亮度较低加剧了这种误差。为了验证平台的光遗传学能力,作者构建了一个基于 EL222 系统 17 的光诱导基因表达路径并对其进行了表征(图 2d)。正如预期的那样,应用不同的蓝光开-关时间模式导致荧光团水平的动态分布覆盖范围很广,从接近零水平(即几乎无法与自体荧光区分)到超过强组成启动子 pTDH3 获得的水平。高诱导表达水平的细胞间变异性也很低,变异系数(CV)值与 pTDH3 启动子相当(0.22 vs 0.20)。
作者组装的第一个平台使用了一个预先存在的定制光生生物反应器阵列。这种设置有几个优点(可靠性、工作容量范围广),但其他实验室无法轻易复制。由于 ReacSight 架构的模块化,可以通过将这个定制的生物反应器阵列与最近描述的开放硬件、光遗传学就绪的商用 Chi.生物反应器(图 2a(右图))交换,快速构建具有类似功能的平台的第二个版本。为了验证该平台的另一版本的性能,作者使用图 2d 中相同的菌株进行了光诱导实验,并获得了各种光诱导曲线的极好的反应器到反应器再现性。
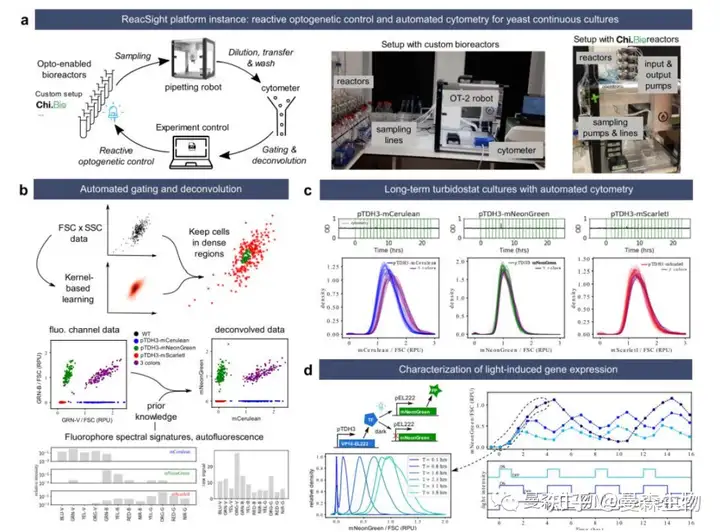
图 2 基于 ReacSight 的自动化平台组装,实现对酵母连续培养物的反应性光遗传学控制和单 细胞解析表征。a 平台概述。Opentrons OT-2 移液机器人用于将支持光基因的多生物反应器 连接到台式细胞仪(Guava EasyCyte 14HT,Luminex)。机器人用于稀释细胞仪输入板中的 新鲜培养样本,并在时间点之间清洗。“点击”Python 库 pyautogui 用于创建细胞仪仪器控制 API。定制算法是在 Python 中开发和实现的,用于实时自动选通和去卷积细胞数据。使用定 制的生物反应器装置(左图)或 Chi 生物反应器(右图)组装了两个版本的平台。b 选通和 反褶积算法说明。例如,显示了重叠荧光团 mCerulean 和 mNeonGreen 之间的反褶积。c 多 代单细胞基因表达分布的稳定性。从 pTDH3 启动子驱动的转录单位中组成性表达 mCerulean、 mNeonGreen 或 mCarlet-I 的菌株(“三色”菌株),整合到染色体中,在浊度调节器模式下生 长(OD 设定值=0.5,上限图),每小时采集一次细胞仪(垂直绿线)。所有时间点的荧光强 度分布(通过高斯核密度估计进行平滑)(选通、反褶积和前向散射归一化后,FSC)用不同 的颜色阴影绘制在一起(下图)。RPU:相对启动子单位(见方法)。为了简单起见,未显示 “三色”的 OD 数据,与其他类似。d 基于 EL222 系统的光驱动基因表达电路的特性。应用 三种不同的开-关蓝光时间剖面图(底部),每 45 分钟采集一次细胞仪。门控、去卷积、FSC 标准化数据的中位数如图所示(顶部)。此图中显示的所有生物反应器实验均在同一天与定 制生物反应器平台版本并行进行。源数据作为源数据文件提供。
2.3 使用光实时控制基因表达
为了展示平台的反应性光遗传控制能力,作者开始动态适应光刺激,以便将 荧光团水平保持在不同的目标设定点。这种用于体内基因表达调控的电子反馈有 助于在存在复杂细胞调控的情况下剖析内源性路径的功能,并有助于将合成系统 用于生物技术应用。作者首先构建并验证了光诱导基因表达的简单数学模型(图 3a)。将三个模型参数与图 2d 的表征数据进行联合拟合,得到了良好的定量一致 性。考虑到模型假设的简单性,这一点值得注意:光激活下的 mRNA 生成速率 恒定,每 mRNA 的翻译速率恒定,mRNA(大部分降解,半衰期为 20 分钟)和 蛋白质(大部分稀释,半衰率为 1.46 小时)的一级衰变。因此,当实验条件得到 很好的控制并且数据得到适当的处理时,人们可以希望用一小套简单的过程来定 量地解释生物系统的行为。然后,作者将拟合模型合并到模型预测控制算法中(图 3b)。该算法与 ReacSight 事件系统一起,实现了对不同反应器中不同目标的荧光 水平的精确实时控制(图 3c)。为了进一步证明平台的稳健性和再现性,作者在 几个月后进行了另一个单 8 反应器实验,涉及两个荧光团目标水平的四个重复反 应器运行。所有的重复都能很好地跟踪目标,并且控制算法决定的 光分布在相同目标的重复之间非常相似,但并不完全相同。
作者还研究了之前使用的诱导系统在更长时间尺度上的遗传稳定性。遗传稳 定性是工业生物生产的一个重要因素。作者观察到,EL222 驱动的 mNeonGreen 蛋白的诱导可以持续 5 天以上,并且具有很好的稳定性(图 3d 顶部)。更进一 步,作者测试了同一蛋白的分泌版本是否表现出类似的表达稳定性。作者观察到, 诱导约2天后细胞水平显著降低。细胞异质性也增加了(图3d右侧)。为了弥补细胞水平的下降,作者将表达盒整合成多个拷贝(三次,串联染色体插入)。诱导后,获得了非常高的荧光水平(图 3d 底部)。令人惊讶的是,这些水平比非分泌蛋白高一个数量级,并伴随着强烈的应激,正如未折叠蛋白应激报告所反映的那样(pUPR mScarletI)。诱导后,细胞内蛋白质水平逐渐下降。细胞内蛋白质水平显示出明显的双峰分布,强烈的遗传不稳定性迹象(图 3d 右侧)。最后,当以最大诱导水平的三分之一诱导时,相同的三重拷贝结构表现出非单调行为:高水平初始反应,随后细胞内水平缓慢下降,如完全诱导的三重结构,随后长期内部高蛋白水平的非预期缓慢恢复(图 3d 底部)。这种恢复可以通过细胞适应高生产需求来解释,或者更可能的是,通过选择高产亚群来解释,该亚群能够更好地保存 HIS3 选择标记,即使在完全培养基中也具有轻微的生长优势。这个实验证明了作者的平台能够执行长时间的实验,并以相对较高的时间分辨率提供单小区信息。此外,它促使探索和利用营养素可用性对健康和压力的影响。
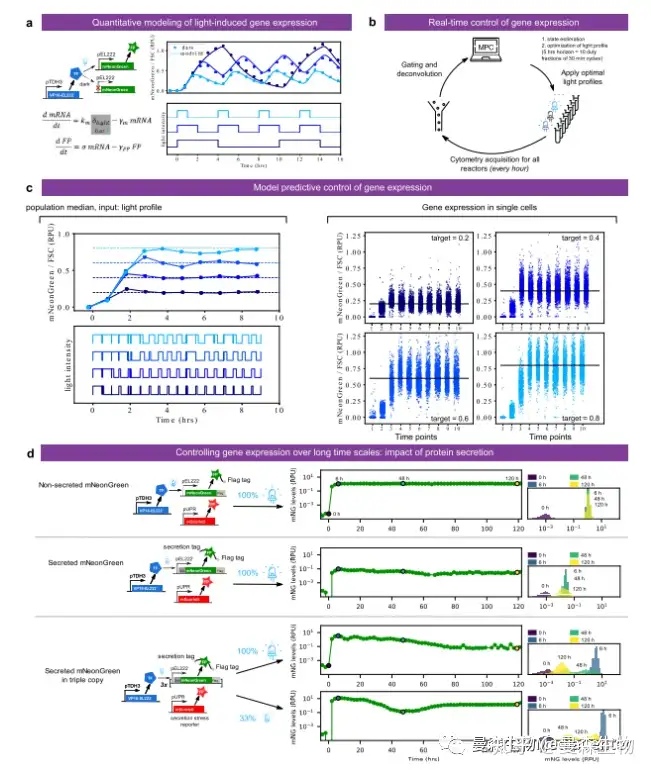
图 3 闭环:使用光实时控制基因表达。a 光驱动基因表达电路的简单 ODE 模型拟合到图 2d 的表征数据。拟合参数为γm=2.09 h−1,σ=0.64 RPU 小时−1,γFP=0.475 小时−1·km 被任 意设置为等于γm,以仅允许从蛋白质中值水平识别参数。b 实时控制基因表达的策略。每 小时进行一次细胞仪采集,在选通、反褶积和 FSC 归一化后,数据被送入模型预测控制(MPC) 算法。该算法使用该模型搜索 10 个周期为 30 分钟的工作循环(即 5 小时的后退地平线)的 最佳占空比序列,以跟踪目标水平。c 四种不同目标水平的实时控制结果,在不同的生物反应器中并行执行(自定义设置)。左:单个单元格的中位数(控制值)。右:单细胞随时间的 分布。请注意,所有绘图都使用线性比例。d 表达系统的长期稳定性和蛋白质分泌的影响。表达 EL222 驱动的 mNeonGreen 荧光报告子的细胞,无论是否分泌,在浊度调节器中生长 5 天,每 2 小时进行一次细胞仪测量。表示整个实验期间的平均表达水平。荧光分布也显示在 选定的时间点(诱导后 0、6、48 和 120 小时)。细胞也有分泌应激的荧光报告子(pUPRmScarlet-I)。还提供了三个拷贝中整合的 mNeonGreen 报告蛋白的分泌形式的结果。相关蛋 白(mNeonGreen 水平)和应激水平(mCarlet-I 水平)分布的时间演变如补充图 11 和 12 所 示。源数据作为源数据文件提供。
曼森生物高通量菌株筛选平台技术
上海曼森生物科技公司专注于高通量、自动化、智能化实验室技术产品开发,逐步形成了全自动化的高通量菌株筛选平台技术,可根据用户需求定制化高通量全自动菌株筛选平台。每天筛选通量可从几千到10万,是人工通量的几十倍上百;在传统生物技术上,加速工业化菌株的遗传进化,帮助提高底物转化率和产量提升;在合成生物技术上,可为选择的平台化合物表达菌株的遗传稳定性、表观遗传进化提升效率。此外高通量筛选必须有高通量的自动化分析检测技术支撑方能发挥最大价值。
未完待续
Mediacenter Editor | 曼森编辑
文章来源:本文由中科院上海生命科学信息中心与曼森生物合作供稿
排版校对:刘娟娟编辑
内容审核:郝玉有博士
END







